Östrojen Metabolitleri
Bursa Şube: Hafta İçi 08:00 - 18:00 / Cumartesi 08:00 - 18:00
Ataşehir-1 Şube: Pazar 08:30 - 17:00


Östrojen Metabolitleri
Meme kanseri, dünya çapında kadınlarda kansere bağlı ölümlerin en yaygın nedeni olmaya devam etmektedir ( 1 ). Yapılan çalışmalar, östrojenlerin, hormonal stimülasyonları nedeniyle hücre proliferasyonu ve tümör ilerlemesi ( 2-5 ) üzerine geniş kapsamlı etkileri olabileceğini göstermektedir ( 6 )
İdrar östrojen metabolitlerinin incelenmesi, hem eksojen hem de endojen östrojen ile meme kanseri ve sonrası mortalite arasındaki ilişkiye ışık tutabilir. Ana endojen östrojenler, estradiol ve estron, 2-hidroksiestron (2-OHE1 ), 4-hidroksestron (4-OHE1 ) ve 16-hidroksestron (16-OHE1 ) olmak üzere üç ayrı geri dönüşümsüz yol ile metabolize edilir ( 8 ). Östrojen metabolitleri ve meme kanseri insidansını araştıran çalışmaların çoğu 2-OHE1 ve 16-OHE1 üzerine odaklanmıştır, çünkü bu iki yol rekabetçi ve birbiriyle yarışan özelliğe sahiptir ( 9 ). Bu iki metabolit farklı östrojenik ve genotoksik potansiyel gösterir.
16-OHE1 ‘in hücre proliferasyonu ve oksidatif stres üzerine güçlü etkileri vardır ve kanserojen olarak kabul edilir ( 9, 10 ); tersine, 2-OHE1 , östrojenik etkileri sınırlı olan muhtemelen bir antiöstrojendir (11 , 12 ). Bu göz önüne alındığında, Bradlow ve ark. ( 13 ) , birbiriyle yarışan iki yol arasındaki dengeyi ölçen 2-OHE1 ve 16-OHE1 oranının , meme kanseri riskinin bir biyobelirteçi olabileceğini öne sürmüştür. Önceki 15 epidemiyolojik çalışmanın yedisi meme kanseri gelişme riskinin, 2-OHE1 ila 16-OHE1 oranı ve 2-OHE1'nin düşük seviyeleri ve /veya 16-OHE1 daha yüksek idrar seviyeleri ile istatistiksel olarak anlamlı derecede ilişkili olduğunu bildirmiştir ( 12, 14-19 ).
Östrojen Metabolizması
Östrojenler, 18 karbon atomlu steroid yapıda hormonlardır. Kolesterolden androjen öncüleri aracılığıyla aromatizasyonla oluşturulurlar (Şekil 1). Östrojenler, menopoz sonrası ve obez kadınlarda, aromataz (CYP19) ile yağ ve kas hücrelerinde daha fazla oluşturulur. Suda çözünmedikleri için kanda büyük ölçüde globülinlere (seks hormonu bağlayıcı globulin = SHBG %37) ve albümine bağlı (%61) taşınır sadece %1-2’si serbest olarak bulunur.
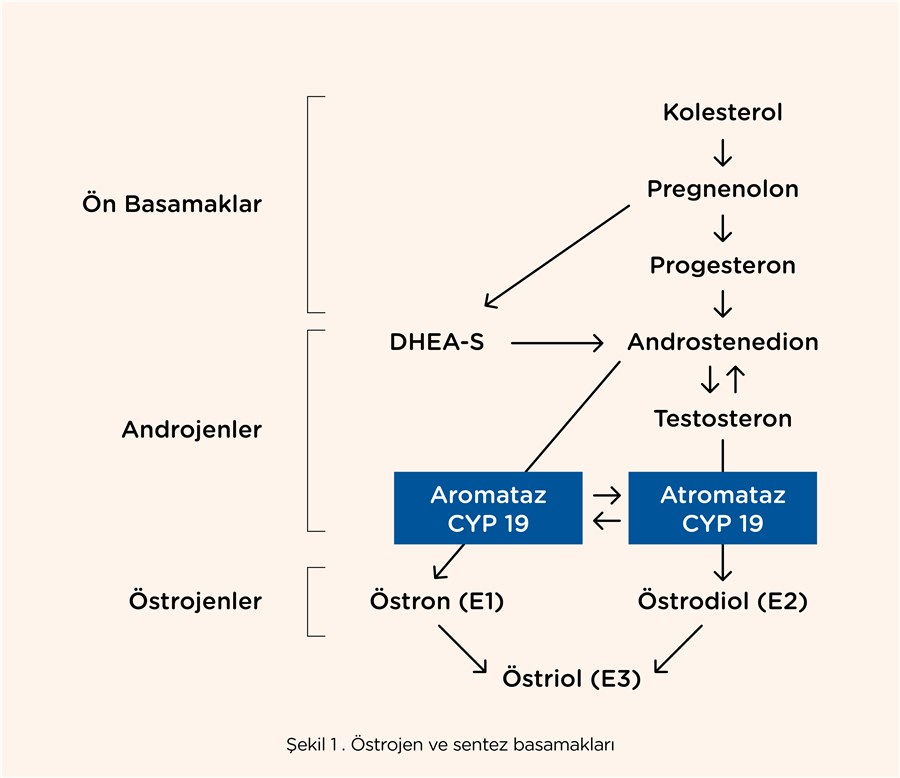
Şekil 1
Menopoz öncesi bir kadın, döngüye bağlı olarak günde 30 ila 300 μg östradiol (E2) üretir. Estradiolün çoğu estron (E1) veya özellikle hamilelik sırasında östriole (E3) dönüştürülür.
Estradiol metabolitlerinin inaktivasyonu esas olarak karaciğerde hidroksilasyon (sitokrom P450 3A4), sülfatlama (sülfataz, sülfotransferaz), metilasyon (katekol-O-metiltransferaz) veya glukuronidasyon (glukuroniltransferazlar) yoluyla böbrek veya safra yoluyla atılan suda çözünür metabolik ürünlerle dönüştürülerek gerçekleştirilir.
Erkekler yaşlılığa kadar sürekli olarak günde yaklaşık 20-50 μg östradiol üretir. Fertil erkeklerle karşılaştırıldığında, subfertil erkekler genellikle aşırı derecede düşük estradiol düzeyine sahiptir. Östrojenin erkeklerde gonadotropin sekresyonu üzerindeki ve dolayısıyla östrojenler ve androjenler arasındaki denge üzerindeki etkisi yaşam boyu devam eder.
Neden östrojen metabolizması değerlendirilmeli?
Östrojen metabolizması ve idrarda 2-hidroksiöstrojenlerin 16a-hidroksiestron metabolitlerinin oranı, hem erkeklerde hem de kadınlarda kanser ve diğer hormonla ilişkili hastalıklar açısından risk altındaki hastaları tanımlamak için kullanılmaktadır. 2-Hidroksilasyon yolu metabolitlerinin seviyelerindeki kısmi artışlar, azalmış risk ile ilişkilidir.
Östrojen Metabolitleri
Östrojen Metabolizmasının değerlendirilmesinde bize en çok yardımı olan parameterlerden biri de idrar metabolitleri ve oranıdır.
Östrojenin koruyucu metabolitleri ve potansiyel olarak mitojenik/mutajenik metabolitleri biyokimyasal özellikleri bakımından farklılık gösterir.
Östron (E1)
Östron (E1), 17β-hidroksisteroid dehidrojenaz (17ß-HSD) yoluyla doğrudan östradiolden (E2) veya aromataz (CYP19) yoluyla androstenediondan üretilir. Östronun sitokrom P450 varyantları aracılığıyla farklı pozisyonlarda hidroksillenmesi durumunda, farklı biyolojik özelliklerle karakterize edilen ve katekolöstrojenler olarak da bilinen C2, C4 veya C16-α-hidroksi-östrojenler oluşur.
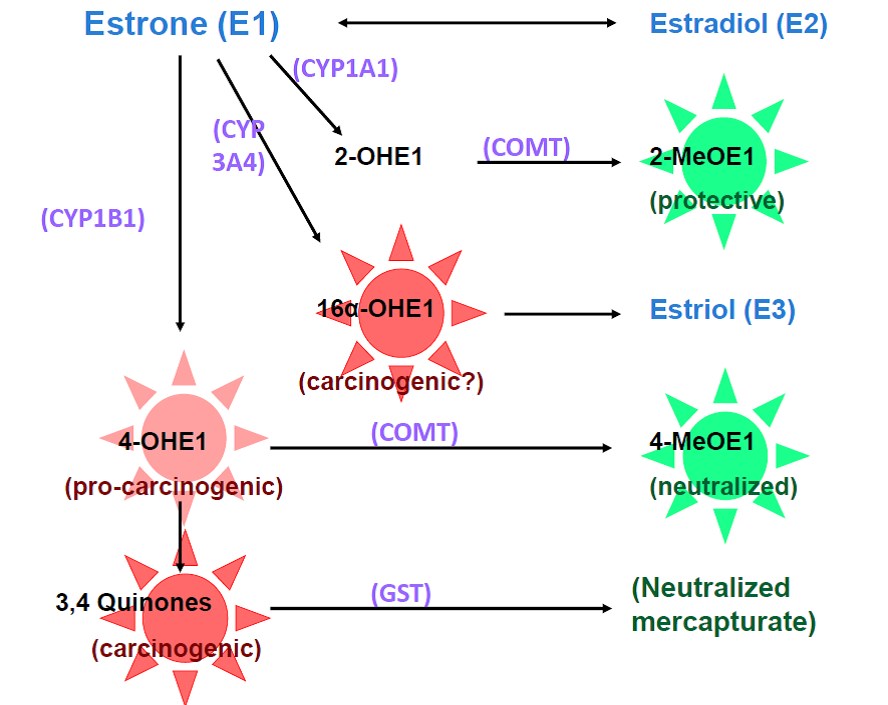
Şekil 2
Koruyucu Metabolitler
2-hidroksi-östron (2-OH-E1)
2-Hidroksi-östrojenler, periferal östrojen reseptörüne düşük bir bağlanma afinitesine sahiptir ve bu nedenle yalnızca zayıf bir östrojenik etkiye sahiptir. Çalışmalar, estradiolün 2-hidroksi-östron (%80-85) ve 2-hidroksi-östradiole yüksek hidroksilasyon oranının, östrojene bağımlı tümörlerin sıklığında bir azalma ile ilişkili olduğunu göstermiştir.
Östradiolün 2-hidroksilasyonu karaciğerde esas olarak CYP1A1 enzimi (CYP = sitokrom P450) tarafından katalize edilir. Bu yolak diyet ile indüklenebilir. örn. Brokolideki özellikle yüksek konsantrasyonlarda oluşan indol-3-karbinol ile.
CYP1A1 genindeki Msp1 gen polimorfizmine bağlı olarak metabolizması değişmiş kadınlarda, indol-3-karbinol uygulamasından sonra 2-hidroksi-estronda anlamlı bir artış görülmez, bu nedenle bu durumda östrojen bağımlı tümör riskinde artış oluşur.
2-OH-E1
- Östrojen reseptörü için düşük bağlanma afinitesi; bu nedenle sadece zayıf östrojenik etki
- Antiproliferatif etkiye sahiptir.
- 2-Hidroksilasyon, diyet düzenlemeleri ile indüklenebilir, örn. Brokoli
Tümörojenik Metabolitler
4-hidroksi-östron (4-OH-E1)
4-hidroksi-östron CYP1B1 yoluyla ekstrahepatik organlarda (meme, yumurtalıklar, böbrekler, prostat, rahim ve plasenta) östradiol veya östrondan oluşur. CYP1B1 polimorfizmi 4-östronda önemli bir lokal artışa yol açabilir, örn. meme dokusunda kurşun.
16α-hidroksi-östrona (16α-OH-E1) benzer şekilde, 4-hidroksi-östron (4-OH-E1) potansiyel olarak kanserojen östrojen metabolitlerinden biridir. Bir yandan, reseptör üzerinde mitotik hızı artıran östrojen-agonistik bir etkiye sahiptir ve bir kinon konjugatı şeklinde doğrudan DNA ile reaksiyona girebilir. 4-hidroksi-östron'un kinon konjugatları kararsız, depurinize edici DNA eklentileri oluşturur. Bunlar, bir tümör başlangıcı olarak hareket edebilen onarılamaz mutasyonlara yol açabilir. Bu etkilerden dolayı 4-hidroksi-östron, potansiyel olarak en tehlikeli östrojen metaboliti olarak kabul edilmelidir.
Meme kanseri dokusunda 2-hidroksi-östrondan önemli ölçüde daha yüksek 4-hidroksi-östron değerleri ölçülmüştür. Buna karşılık, sağlıklı meme dokusunda oran yaklaşık olarak aynı olduğu gözlenmiştir (Liehr JG ve Ricci, 1996).
Cavalieri ve ark. ve Zahid ve ark. Tarafından Resveratrol ve N-asetilsistein gibi spesifik antioksidanların, katekol östrojenlerin kinonlara oksidasyonunu bloke ettiğini ve böylece 4-hidroksi östrojenlerin potansiyel mutajenitesinin azaltabileceği gösterilmiştir.
4-OH-E1
- Östrojen benzeri etki
- Meme kanseri ile pozitif korelasyon
- Kinon konjugatı aracılığıyla doğrudan DNA ile reaksiyona girebilir ve mutasyonları tetikleyebilir.
- Resveratrol (örneğin mavi üzümlerin kabuğunda, fıstık ve ahudududa bulunur) ve N-asetilsistein, katekolik östrojenlerin kinonlara oksidasyonunu bloke eder
16α-hidroksi-östron (16α-OH-E1)
16α-hidroksi-estron, güçlü östrojenik etkisi olan bir metabolittir. 16α-OH-E1'in seks hormonu bağlayıcı globulin (SHBG) için düşük bağlanma afinitesi nedeniyle hedef dokuya hızlı penetrasyon sağlar.
16α-OH östrojenleri, östrojen reseptörüne, nükleer histonik proteinlere ve DNA'ya kovalent olarak bağlanabilir. Östrojen reseptörüne geri dönüşümsüz bağlanma, uzun süreli bir etkiye, yani mitozda artış ve artan mutasyon riskiyle kalıcı DNA stimülasyonuna neden olur.
Meme kanseri olan kadınlarda ve meme kanseri riski yüksek olan kadınlarda, 16α-OH östrojenlerinin östrojen reseptörüne bağlanmasının arttığı gösterilmiştir.
16α-OH-E1
- Östrojen benzeri etkisi
- Meme kanseri ile pozitif korelasyon
- Östrojen reseptörüne geri dönüşümsüz bağlanma
- Uzun süreli etki
2- / 16α-OH-E1 oranı
2-hidroksi-östron ve 16α-hidroksi-östron metabolitleri ve oranları belirlenerek östrojen metabolizmasındaki değişiklikler hakkında fikir sağlanabilir.
Kadınlarda östrojen oranı düzeyi ile meme kanseri göreceli riski arasında bir bağlantı vardır. Araştırmalar bunun ters orantılı olduğunu göstermektedir.
Yüksek 2- / 16α-östrojen oranına sahip postmenopozal kadınlarda meme kanseri gelişme riski ortalama %30 daha düşüktür. Meme kanserli premenopozal kadınlarda sağlıklı kadınlara göre daha düşük 2- / 16α-OH-E1 oranı ve daha yüksek 16α-OH-E1 oranı tespit edilmiştir.
Bir kadının bireysel 2- / 16α-östrojen oranı yalnızca genetik yapıya bağlı değildir. Çeşitli diyet önlemleri ve yaşam tarzı faktörleri, CYP1A1 geninin indüklenmesi yoluyla östrojenlerin 2-hidroksilasyonunu etkileyebilir ve böylece 2- / 16α-OH-E1 oranında bir artışa neden olabilir. Bu, uzun vadeli riskte bir azalmaya yol açabilir.
Olumlu etkiler esas olarak brokoli, lahana veya brüksel lahanası gibi turpgillerden sebzelerin bir bileşeni indol-3-karbinole atfedilir. Bu sebzeleri günde 1-2 öğün yemek meme kanseri riskini önemli ölçüde azaltabilir.
2- / 16α-OH-E1 oranının düzenlenmesinde balıklardan elde edilen omega-3 yağ asitleri eikosapentaenolik asit (EPA) ve dokosaheksaenolik asit (DHA) de etkilidir.
2- / 16α-OH-E1 oranı
- Östrojen metabolizmasındaki değişiklikler hakkında bir açıklama sağlar
- Kadınlarda oran düzeyi ile göreceli meme kanseri riski arasındaki ters ilişki
- Sadece genetik faktörlere bağlı değil
- Diyet önlemleriyle olumlu etkilemek mümkün
- Ne kadar yüksek olursa o kadar iyi
- Artan östrojen oranı, prostat kanserli erkeklerde daha kötü bir prognoz ile ilişkilidir.
2- / 16α-OH-E1 Oranını Belirlemek İçin Endikasyonlar
- Birinci derece akrabalarda (anne, kız kardeş) meme kanseri
- Uzun bir süre boyunca oral kontraseptif veya hormon replasman tedavisi almak
- Obezite
Östrojen Metabolitleri, İdrar Örnek Alım Koşulları ve Test Öncesi dikkat edilmesi gerekenler
Örnek Türü: Sabah idrarı (gece idrar için kalkılacak olunursa bu idrarı ve sabah ilk idrarı karıştırılmalıdır).
Adet döneminde örnek alınmaz
Özel bir taşıma koşulu bulunmamaktadır.
Menopoz öncesi kadınlar: Adet döngüsünün 19. ve 25. günler arasında örnek alımı uygundur.
Menopozdaki kadınlar: Herhangi bir gün idrar örneği alınabilir.
Hormon Replasman Tedavisi Alan Kadınlar: Hormon içeren herhangi bir ilacın son dozundan yaklaşık 8-10 saat sonra örnek alımı uygundur.
Takip testi: Örneğin önceki örnek ile aynı döngü veya hormon tedavisi fazında alınması esastır.
Test öncesi nelere dikkat edilmesi gerekir?
- Tamoksifen, doğum kontrol hapları, antibiyotikler, hormon replasman tedavileri ve bitkisel ve besin takviyeleri gibi hormon düzeyini etkilebilen maddeler sonuçları değiştirebilir.
- Bazı ilaçlar idrar kreatinin düzeylerini etkileyebilir (örn. Bactrim, Tagamet).
- Bazı ilaçlar test sonuçlarını etkileyebilir (örn. sefalosporinler, simetidin, fibratlar ve trimetoprim-sülfametoksazol).
- Doktorunuza bunlar ve son 3 ay içinde kullandığınız diğer ilaçlar, şifalı bitkiler ve takviyeler hakkında bilgi verin. Hekiminiz tarafından talimat verilmedikçe takviyelerin veya ilaçların kullanımını değiştirmeyin.
- Anormal böbrek fonksiyonu veya diüretik kullanımı test sonuçlarını etkileyebilir.
- Bu test böbrek rahatsızlığı olan kişilere yapılmamalıdır.
- İdrar yolu enfeksiyonunuz varsa tedaviniz tamamlanana kadar idrar toplamayı geciktirin.
Östrojen metabolizmasında 2/16 oranının değerlendirilmesi
Östrojen Metabolizmasının değerlendirilmesinde bize en çok yardımı olan idrar metabolitlerinin oranın gösteren bir testtir. Bu testte;
- 16α-hidroksiestron (16α-OH E1)
- 2-hidroksiestron ve 2-hidroksiestradiol (2-OHE1 + 2-OHE2) ölçülür ve
2/16 hidroksiöstrojen oranı bu sonuçlara göre hesaplanır.
Sonuçlar klinik olarak nasıl faydalı olabilir?
Östrojen metabolitleri, özellikle 16-alfa-hidroksestron (16α-OHE1) ve 2-hidroksestronda çeşitli meme kanseri çalışmalarında incelenmiştir. Bu iki bileşiğin östrojenik özellikleri, östrojen reseptörüne bağlanma yeteneklerine göre değişir. 16α-OHE1, östrojen reseptörüne güçlü bağlanma afinitesi gösterdiği için östrojen benzeri bir metabolittir; aksine, 2-hidroksiestron metaboliti, östrojen reseptörüne düşük bağlanma afinitesine ve zayıf östrojenik etkiye sahiptir. İki metabolitin üretimi birbirinin tersidir; bu nedenle, iki bileşikten birinin üretimini modifiye eden herhangi bir dış faktör, diğerinin dolaylı modifikasyonundan da sorumludur. Örneğin, turpgillerden zengin sebzeler 2:16 OHE oranını artırabilir(20).
2/16 oranını bilmek klinik olarak önemlidir, çünkü östrojen metabolizması aşağıdakiler ile ancak bunlarla sınırlı olmamak üzere çeşitli diyet ve yaşam tarzı değişiklikleriyle değiştirilebilir:
- egzersiz yapmak
- sigara bırakma
- sebze ile beslenme
- esansiyel yağ asitleri tüketimi
- keten tohumu
ÖRNEK RAPOR
Referanslar
1. Bray F, Ferlay J, Soerjomataram I, vd. Küresel kanser istatistikleri 2018: GLOBOCAN, 185 ülkede 36 kanser için dünya çapında insidans ve mortalite tahminleri yapıyor . CA: Kanser J Clin . 2018; 68 ( 6 ): 394-424. [ PubMed ] [ Google Akademik ]
2. Persson I, Yuen J, Bergkvist L, vd. Östrojen ve östrojen-progestin replasman tedavisi alan kadınlarda kanser insidansı ve mortalitesi - İsveçli bir kohortun uzun süreli takibi . Int J Kanser . 1996; 67 ( 3 ): 327-332. [ PubMed ] [ Google Akademik ]
3. Grodstein F, Stampfer MJ, Colditz GA, vd. Menopoz sonrası hormon tedavisi ve mortalite . N Engl J Med . 1997; 336 ( 25 ): 1769-1775. [ PubMed ] [ Google Akademik ]
4. Holli K, Isola J, Cuzick J. .. Hormon replasman tedavisi kullanan kadınlarda meme kanserinde düşük biyolojik saldırganlık . J Clin Oncol . 1998; 16 ( 9 ): 3115–3120. [ PubMed ] [ Google Akademik ]
5. Rock CL, Flatt SW, Laughlin GA, vd. Meme kanseri öyküsü olan kadınlarda üreme steroid hormonları ve rekürrenssiz sağkalım . Kanser Epidemiol Biyobelirteçleri Önceki . 2008; 17 ( 3 ): 614-620. [ PMC ücretsiz makale ] [ PubMed ] [ Google Akademik ]
6. Henderson BE, Feigelson HS .. Hormonal karsinogenez . Kanserojenez . 2000; 21 ( 3 ): 427-433. [ PubMed ] [ Google Akademik ]
7. Folkerd E, Dowsett M. Seks hormonları ve meme kanseri riski ve prognozu . Meme (Edinburgh, İskoçya) . 2013; 22 (ek 2 ): S38-43. [ PubMed ] [ Google Akademik ]
8. Gruber CJ, Tschugguel W, Schneeberger C, et al. Östrojenlerin üretimi ve etkileri . N Engl J Med . 2002; 346 ( 5 ): 340-352. [ PubMed ] [ Google Akademik ]
9. Ziegler RG, Fuhrman BJ, Moore SC, vd. Östrojen metabolizması ve meme kanseri epidemiyolojik çalışmaları . Steroidler . 2015; 99 ( pt A ): 67-75. [ PMC ücretsiz makale ] [ PubMed ] [ Google Akademik ]
10. Crooke PS, Justenhoven C, Brauch H, vd. Meme kanseri riskinin tahmini için bir genotipik-fenotipik modelde östrojen metabolizması ve maruz kalma . Kanser Epidemiol Biyobelirteçleri Önceki . 2011; 20 ( 7 ): 1502–1515. [ PMC ücretsiz makale ] [ PubMed ] [ Google Akademik ]
11. Okobia MN, Bunker CH .. Östrojen metabolizması ve meme kanseri riski – bir gözden geçirme . Afr J Reprod Sağlık . 2006; 10 ( 1 ): 13-25. [ PubMed ] [ Google Akademik ]
12. Kabat GC, O'Leary ES, Gammon MD, vd. Östrojen metabolizması ve meme kanseri . Epidemiyoloji (Cambridge, Mass) . 2006; 17 ( 1 ): 80-88. [ PubMed ] [ Google Akademik ]
13. Bradlow HL, Davis DL, Lin G ve diğ. Pestisitlerin 16 alfa / 2-hidroksiestron oranı üzerindeki etkileri: meme kanseri riskinin biyolojik bir belirteci . Çevre Sağlığı Perspektifi . 1995; 103 (ek 7 ): 147-150. [ PMC ücretsiz makale ] [ PubMed ] [ Google Akademik ]
14. Kabat GC, Chang CJ, Sparano JA, vd. Üriner östrojen metabolitleri ve meme kanseri: bir vaka kontrol çalışması . Kanser Epidemiol Biyobelirteçleri Önceki . 1997; 6 ( 7 ): 505-509. [ PubMed ] [ Google Akademik ]
15. Fowke JH, Qi D, Bradlow HL ve diğ. Üriner östrojen metabolitleri ve meme kanseri: tedavi öncesi ve sonrası toplamada bulunan farklı risk modeli . Steroidler . 2003; 68 ( 1 ): 65-72. [ PubMed ] [ Google Akademik ]
16. Im A, Vogel VG, Ahrendt G, vd. Meme kanseri riski yüksek olan kadınlarda idrar östrojen metabolitleri . Kanserojenez . 2009; 30 ( 9 ): 1532–1535'te açıklanmaktadır. [ PMC ücretsiz makale ] [ PubMed ] [ Google Akademik ]
17. Schneider J, Kinne D, Fracchia A ve diğ. Meme kanseri olan kadınlarda östradiolün anormal oksidatif metabolizması . Proc Natl Acad Sci ABD . 1982; 79 ( 9 ): 3047-3051. [ PMC ücretsiz makale ] [ PubMed ] [ Google Akademik ]
18. Eliassen AH, Spiegelman D, Xu X, vd. Premenopozal kadınlarda idrar östrojenleri ve östrojen metabolitleri ve ardından meme kanseri riski . Kanser Arş . 2012; 72 ( 3 ): 696-706. [ PMC ücretsiz makale ] [ PubMed ] [ Google Akademik ]
19. Sampson JN, Falk RT, Schairer C, vd. Postmenopozal kadınların farklı gruplarında östrojen metabolizmasının meme kanseri riski ile ilişkisi . Kanser Arş . 2017; 77 ( 4 ): 918-925. [ PMC ücretsiz makale ] [ PubMed ] [ Google Akademik ]
20. Lord RS ve diğ. Östrojen metabolizması ve diyet-kanser bağlantısı: üriner hidroksillenmiş östrojen metabolitlerinin oranını değerlendirmenin mantığı. Altern. Med. Rev. 2002; 7 : 119–129'da açıklanmaktadır. [ PubMed ] [ Google Akademik ]

Ülkesi

Merkezi





